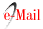Serviços
An. 3. Enc. Energ. Meio Rural 2003
Biodiesel a partir de óleos vegetais
Gonzalez W.A.; Nunes P.P.; Ferreira M.S.; Martins E.P.; Reguera F.M.; Pastura N.M.R.
Grupo de Catálise, Departamento de Engenharia Química, Instituto Militar de Engenharia, IME, CEP 2290-270 Rio de Janeiro, RJ tel.: (21) 546-7052 ou (21) 546-7053 ou (21) 546-7055 fax.:(21) 546-7059
RESUMO
A obtenção de combustíveis alternativos, a partir da transformação catalítica de óleos vegetais é uma possibilidade promissora, originária das crises mundiais do petróleo, ocorridas em 1973 e 1978, apresenta a vantagem sobre as demais fontes de energia por não esgotar o solo e não agredir o meio ambiente.
O Grupo de Catálise do IME, desenvolve pesquisas de fontes renováveis de combustível desde 1979, com publicação de diversos trabalhos. A princípio, foram pesquisados vários óleos vegetais, onde foi evidenciado à necessidade da pré - hidrogenação do óleo, para aumentar o rendimento em hidrocarbonetos na faixa do diesel. Entretanto, no estudo da acidez de catalisadores sólidos, foram comparados catalisadores ácidos de Brönsted e Lewis suportados, de diferentes forças ácidas, utilizou-se além do óleo de soja não hidrogenado, o de babaçu, o de pinhão manso e bravo e ainda, ácidos graxos como composto modelo. Paralelamente, foram estudados ácidos carboxílicos como composto modelo e a reforma de óleo vegetal sobre catalisadores ácidos a base de nióbio, zeólitas modificadas ou não por terras raras,.visando aumentar o rendimento em biodiesel. O objetivo deste trabalho é mostrar, desde o final da década de 70, as pesquisas quem vêm sendo desenvolvidas no IME, visando o uso de óleos vegetais como fonte renovável de energia.
Palavras-chave: BIODIESEL, CRAQUEAMENTO DE ÓLEOS VEGETAIS, CATALISADOR ÁCIDO, H3PO4/SiO2, Nb2O5
ABSTRACT
Get alternative combustile from vegetable oils using catalytic transformation is a very interesting possibility, that begin to be research from petroleum crisis in 1973 and 1978, has an advantage from others ways of energy because it do not vanish the soil nor harmful the ambient.
IME catalysis group development research in combustile renewable source since 1979, with several publications. At first, were researched several vegetable oils and were evident that oils must be pre - hydrogenated in order to improve the quantity of hydrocarbons like diesel oil. So far, when the acidity of solids catalysts were studied, Brönsted and Lewis acidity from supported catalysts with differents acidity were compared, using soinbean oil not hydrogenated, babaçu and "pinhão manso and wild", and others fatty acids as models compounds. So, carboxylic acid were studies as models compounds and the vegetable oil reforming on acids catalysts with niobium, modifying zeolites or not by rares earth, in order to get more quantity in biodiesel. This paper objective is notice the research that since 1970 decade is done by this group improving vegetable oils as renewable energy source
INTRODUÇÃO
Este estudo teve sua origem com as crises mundiais do petróleo, ocorridas em 1973 e 1978. O Brasil, carente de reservas suficientes para atender suas necessidades em combustível para motores, procurou fontes alternativas que pudessem suprir a demanda interna. Assim, para os motores tipo Diesel várias soluções foram aventadas na época, ressaltando-se como as principais a utilização do etanol em mistura com explosivo conveniente e o aproveitamento dos óleos vegetais. Devido aos riscos do uso de substâncias explosivas, foi escolhida como alternativa o uso de óleo vegetal, que já havia sido sugerida pelo próprio Diesel em 1912. A transformação de óleo vegetal em uma mistura de hidrocarbonetos o mais semelhantes possível ao diesel, através de uma degradação térmica ou catalítica dos triglicerídeos que constituem o óleo vegetal, foi a linha escolhida pelo IME para ser desenvolvida.
Sob o ponto de vista da qualidade do combustível esta é a linha que melhor atenderia ao problema. Não haveria necessidade de nenhuma modificação ou adaptação dos motores, bem como não teríamos nenhum problema novo de corrosão ou poluição, de vez que o combustível seria idêntico, em sua natureza, ao já utilizado. Justifica-se sua escolha pelos brutais aumentos que vinha sofrendo o petróleo, naquela época, no mercado internacional, se a alta do petróleo tivesse continuado naquela escalada, provavelmente, hoje já seria compensador produzir o diesel por este processo. Contudo, a reversão do mercado pode levar a não utilização imediata deste processo, mas acreditamos que seja útil não só preservar estas informações aqui obtidas como também procurar ampliar ainda mais o conhecimento deste assunto, não abandonando as pesquisas, pois que certamente será bastante valioso no futuro, uma vez que, as fontes atuais de exploração de petróleo são irreversíveis.
As primeiras informações sobre degradação de óleos vegetais datam de 1838 com Brandes (1), quando ao destilar o óleo de coco obteve o propenal, aldeído gerado da dupla desidratação do glicerol ao qual Berzelius denominou de "acroleína" (óleo estragado, degradado).
A primeira constatação da formação de mistura de hidrocarbonetos pela degradação térmica dos óleos vegetais ou animais (triglicerídeos) foi feita em 1888 com os trabalhos de Engler e Seidner sobre o craqueamento térmico de óleo de peixe sob uma pressão compreendida entre 4 e 10 atm. Este trabalho serviu para sustentar a hipótese da origem orgânica do petróleo (2).
Em 1921, na França com Mailhe (3) e no Japão com Kobayashi (4) vão aparecer os primeiros trabalhos empregando catalisadores para auxiliar a transformação dos óleos vegetais em hidrocarbonetos. Os catalisadores usados por ambos são essencialmente do tipo ácido, tendo sido empregadas argilas naturais (Kobayashi), alumina, cloretos de zinco e de alumínio (Mailhe). Os trabalhos de Mailhe foram bastante extensos, estudando vários óleos e diversos compostos como glicerídeos preparados e alguns ácidos carboxílicos, que foram apresentados em diversos artigos.
Em 1924 Wattermann aplica o processo Bergius de síntese de hidrocarbonetos por hidrogenação de carvão a alta pressão de H2 ao óleo vegetal e obtém uma conversão quase total destes hidrocarbonetos, trabalhando com uma pressão bastante elevada, atingindo a 200 atm de H2 (5). Ao que parece não utilizou as modificações introduzidas por Pier ao processo de Bergius, ou seja a aplicação de catalisadores à base de sulfeto, para auxiliarem na hidrogenação.
Em 1930 Egloff (6-8) faz a primeira tentativa de industrialização de um processo de obtenção de hidrocarbonetos a partir do óleo vegetal.
De 1934 a 1947 foram desenvolvidos diversos trabalhos pelos chineses, com um cunho industrial, visando a obtenção de gasolina. Utilizaram basicamente catalisadores ácidos e chegaram a produzir gasolina por este processo, suprindo partes de suas necessidades (9-16). Seguem-se os trabalhos dos hindus com Metha (17-20), também desenvolvidos na década de 40, sem trazer grandes inovações ao que já era conhecido.
No período compreendido entre o final da 2° Guerra Mundial e a crise de 1973, são muito raros ou de pouca importância os trabalhos publicados sobre o assunto, devendo-se este fato, sobretudo ao baixo custo de petróleo naquela época.
No IME as pesquisas sobre o craqueamento de óleos vegetais foram iniciadas com óleo de soja, em um reator designado de contato a vapor, onde os vapores formados de sua degradação térmica (21-23), no interior de um balão de vidro, ascendiam numa coluna vertical passando por um leito catalítico, após o que eram separados numa fração gasosa, utilizou-se catalisadores ácidos como alumina e sílica-alumina e básicos como o MgO. O resultado mais importante deste trabalho foi mostrar a necessidade de se fazer uma pré-hidrogenação de óleo para aumentar o rendimento em hidrocarbonetos de cadeia longa na faixa do diesel.
Paralelamente aos estudos em andamento, procurou-se realizar a hidrogenação e o craqueamento do óleo em uma única etapa, procurando assim diminuir os custos de projeto.
Estabelecendo uma correlação com os catalisadores, a base de sulfetos, como sulfeto de molibdênio, utilizados na reação de dessulfurização, procurou-se estudar o óxido na tentativa de fazer uma desoxigenação (24).
No estudo da acidez de catalisador sólido no craqueamento de óleo vegetal, trabalhou-se basicamente com óleos não hidrogenados, estudando além do óleo de soja, o óleo de babaçu, o de pinhão bravo e ainda o ácido oleico como composto modelo. Deu um cunho mais profundo ao estudo das características ácidas do catalisador, comparando ácidos de Brönsted como H3PO4, H3BO3 e H2SO4 e de Lewis como AlCl3, ZnCl2, de forças ácidas diferentes todos suportados em sílica e ainda o H3PO4/carvão, H3PO4/mordenita, ZnCl2/carvão. O reator utilizado foi designado de contato direto. A conclusão mais importante deste trabalho foi a verificação da alta atividade de catalisadores ácidos, do tipo Brönsted, com uma força ácida intermediária, destacando-se como o mais eficiente dentre os estudados o de H3PO4/SiO2 (25-32).
PROCEDIMENTO EXPERIMENTAL
Os testes foram realizados em um reator de fluxo contínuo, onde o óleo era vaporizado numa zona de pré-aquecimento sofrendo, provavelmente, já aí alguma degradação térmica, é arrastado por fluxo de hidrogênio passando através de um leito catalítico. Na saída, o produto era separado em frações líquidas, recolhidas a intervalos de tempo determinados, e em uma fração gasosa, não condensável, a pressão e temperatura ambientes. Embora, os resultados obtidos com o catalisador de Mo/Al2O3 tenham sido promissores, apresentando como curiosidade a ação hidrogenante nas condições de operação, pressão de hidrogênio de 1 atm e temperatura de 400° C, condições brandas para um processo de hidrogenação, este projeto não está sendo desenvolvido no momento, em decorrência dos resultados obtidos com o catalisador à base de H3PO4 suportado em sílica, em atmosfera de nitrogênio.
Outros estudos foram desenvolvidos paralelamente, cujo objetivo estratégico era verificar a potencialidade do ácido nióbico, matéria prima nacional, como catalisador. Neste trabalho foram avaliados os sólidos, Nb2O5, obtidos a partir da decomposição térmica do ácido nióbico, na reação de transformação do óleo de soja
O teste catalítico foi realizado em um micro reator de leito fixo e fluxo contínuo, a 350 oC, sob fluxo de N2. Os produtos líquidos de reação foram recolhidos em duas frações, de 30 minutos cada, e analisados por cromatografia gasosa, espectroscopia de massas e de infravermelho, por RMN de 13C e de 1H. A análise dos resultados mostrou que o produto líquido é formado de uma mistura de parafinas, olefinas, aromáticos e ácidos graxos e que o catalisador calcinado à 250 oC apresentou melhor desempenho para a produção de parafinas (33-34).
PROCESSOS DE TRANSFORMAÇÃO
No processo de contato – vapor, utilizou-se um reator batelada onde, catalisadores eram previamente ativados sob fluxo de diferentes gases. Em seguida o óleo vegetal foi vaporizado à pressão atmosférica e à temperatura de aproximadamente 300 oC. Os vapores do óleo passavam sobre o leito catalítico , previamente ativado à temperatura de 400 oC, a fração condensável resultante da transformação foi recolhida em um balão (Figura 1). Todos os testes utilizaram 10,0 g de óleo e foram realizados sobre 4,0 g de catalisador (Al2O3 - h ou Al2O3 - g).
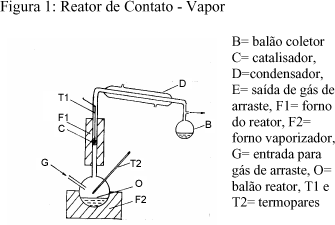
No processo contato direto (figura 2), com refluxo, também foi empregado um reator batelada, onde 5,0 g de catalisador foram diluídos com 5,0 g de SiO2. Estes eram pré-tratados, por 2 horas a temperatura desejada , quando então 10,0 g do óleo vegetal eram adicionados , deixando-se em contato durante 1 hora à temperatura de 400 oC, após este tempo de reação, a fonte de aquecimento era retirada imediatamente e o balão reator resfriado até a temperatura ambiente e o produto líquido era então separado do catalisador por filtração.
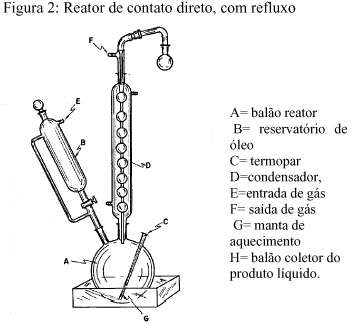
No processo contato direto com destilação (figura 3), foram colocados 5,0 g de catalisador no balão reator, que era acoplado a um sistema injetor de óleo vegetal e a um condensador. Após o pré-tratamento do catalisador iniciava-se a adição de 29 g do óleo vegetal com vazão controlada, durante 1 hora, à temperatura de 400 oC. A medida em que ocorria a reação, os produtos destilados e condensados, eram recolhidos para posteriores análises.
O processo contínuo de transformação do óleo (figura 4), em uma primeira etapa, foi realizado em reator de leito fixo e fluxo contínuo, na presença de hidrogênio, à temperatura de 400 oC. Este tipo de reator foi escolhido por permitir a obtenção contínua de produto e o estudo da desativação dos catalisadores. A presença de hidrogênio se fez necessária para manter o estado dos catalisadores de molibdênio na forma reduzida. Os testes foram realizados com 2,0 g de catalisador com a adição de aproximadamente 13,0 g de óleo cru. Posteriormente, o gás de arraste foi mudado para nitrogênio quando foram avaliados óxidos ácidos.
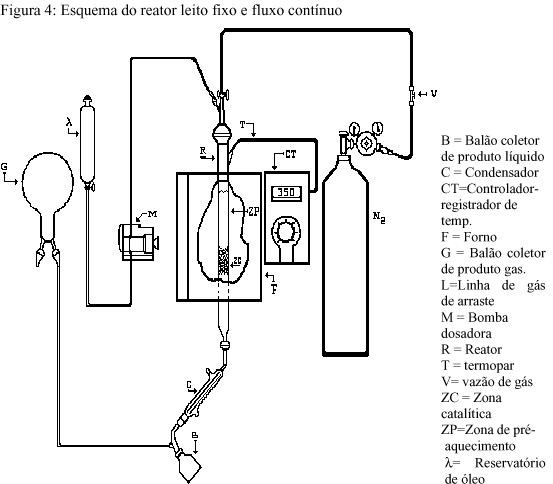
Os testes com catalisadores de nióbio foi realizado em reator de leito fixo e fluxo contínuo, utilizando como matéria prima o produto da transformação térmica do óleo de soja, com vazão de 20g.h-1 para 5g de catalisador, a 350 oC, sob fluxo de 1,26 L.h-1 de N2 (figura 4), este teste foi denominado de reforma do óleo. Os produtos líquidos de reação foram recolhidos em duas frações, de 30 minutos cada, e analisados quanto à medida de acidez(1), por cromatografia gasosa(3), espectroscopia de massas e de infravermelho, por RMN de 13C e de 1H.
PREPARAÇÃO DOS CATALISADORES
Os catalisadores suportados preparados no laboratório, foram obtidos pelo método da impregnação, utilizando-se o processo do ponto úmido. Estes foram secos a 110 oC em estufa por 16 horas e pré - tratados "in situ", a 450 oC, durante duas horas.
O pentóxido de nióbio foi preparado por decomposição térmica do ácido nióbico a temperaturas de150, 250, 350, 450 e 550 oC. Estas amostras foram denominadas de A1, A2, A3, A4 e A5, respectivamente. Inicialmente o sistema foi aquecido sob programação de temperatura de 5K.min-1 até atingir 100 oC e mantido em isoterma durante 3horas. Após esta etapa de secagem, a temperatura foi aumentada até o valor desejado (Tf) e deixada em isoterma por 4 horas.
CARACTERIZAÇÃO DOS CATALISADORES
Os sólidos assim obtidos foram caracterizados por difração de raios X (DRX), pela superfície específica e porosidade pelo método BET, medida de acidez por indicadores de Hammett e espectroscopia de infravermelho.
CARACTERIZAÇÃO DOS PRODUTOS DE TRANSFORMAÇÃO DOS ÓLEOS
A Medida de acidez: representa o número de milimoles (mmoles) de ácido livre por grama de amostra. O procedimento é semelhante ao descrito nas normas IUPAC como método de determinação do índice de acidez de óleos e gorduras, consiste em adicionar à uma massa aproximada de 0,1 g de amostra, 10,0 mL de uma solução 1:1 de benzeno e etanol e titular com uma solução de KOH etanólico 0,1N, utilizando-se fenolftaleína como indicador. O número de milimoles ácidos na amostra (Ma) é calculado pelo número de mmoles de KOH consumido na titulação e pode ser calculado pela expressão:
Ma = [(VKOH.fKOH.0,1)/m] mmol.g-1 , onde,
VKOH representa o volume, em mL de KOH consumidos na titulação, fKOH representa o fator da solução 0,1 N de KOH determinado no momento do teste, uma vez que este sofre variação em função do tempo e m representa a massa de amostra de produto líquido analisada em gramas.
Medida de Saponificação: representa o número de milimoles saponificáveis, isto é, éster ou ácidos transformados em sal de ácido graxo por grama de amostra. Pode ser obtido através do Ïndice de saponificação (I.S.) para óleos vegetais conforme o procedimento IUPAC, pesa-se com precisão 0,1 g de amostra, adiciona-se 10 mL de KOH etanólico 0,1 N, aquecendo esta mistura até a ebulição e deixando em refluxo, com agitação durante 1 hora. O KOH que não reagiu é titulado com uma solução de HCl 0,1N, utilizando-se fenolftaleína como indicador.
O número de milimoles de KOH consumidos fornece o número de milimoles de ácido livre mais o número de milimoles de ésteres presentes na amostra. O valor da medida de saponificação (Ms) pode ser calculado pela expressão:
Ms = [(VKOH.fKOH.0,1) - (VHCl.fHCl.0,1)/m] mmol.g-1,
onde, VKOH representa o volume, em mL de KOH, fKOH representa o fator da solução 0,1 N de KOH, VHCl representa o volume, em mL de HCl consumidos na titulação, fHCl representa o fator da solução 0,1 N de HCl, e m representa a massa de amostra analisada em gramas.
RESULTADOS
A tabela 1 apresenta rendimentos ponderais em produtos gasosos e líquidos utilizando-se o reator de contato – vapor, a partir de 10,0 g de óleo e 4,0 g de catalisador. O resultado do craqueamento térmico a 400 oC também foi realizado para comparação.

Durante a vaporização a 300 oC, o óleo inicia sua degradação e polimerização, porém a 400 oC, sobre as esferas de vidro, ocorre o craqueamento térmico. Nessas condições, 35 % do óleo inicial foram perdidos como resíduos sólidos. A análise do espectro de infravermelho deste produto, comparada com o do óleo vegetal mostra diminuição das bandas de éster e alargamento das bandas carbonilas. Estas modificações estão ligadas à quebra parcial da ligação C-O da cadeia, gerando ácidos, cetonas, aldeídos, etc.
Foi realizado um estudo comparativo para escolha do reator a ser utilizado, na transformação de 10,0 g de óleo de soja não hidrogenado (Ma=0,01 e Ms=3,34), usando como catalisador 2,5 g de alumina. O tempo de reação foi de 1 hora. A tabela 2 mostra os resultados obtidos, à temperatura de 400oC, sob fluxo de nitrogênio 1,26 L.h-1.
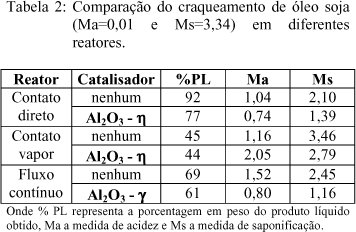
A influência do craqueamento térmico pode ser observada nos três sistemas. Verifica-se uma competição entre o craqueio térmico e o catalítico mostrada pelas comparações dos valores de Ma e Ms , nos testes realizados em presença e ausência de catalisador. Esta influencia também é dependente do tempo de residência de cada reator. O reator de contato vapor, apresentou o menor grau de craqueamento devido ao menor tempo de residência
A comparação entre estes reatores, foi realizada também, utilizando-se o ácido fosfórico suportado em sílica como catalisador. Os resultados desta avaliação estão mostrados na tabela 3.
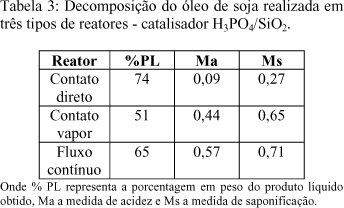
A comparação entre os resultados das tabelas 2 e 3 mostra que o reator de contato direto é aquele que apresenta produto líquido com menor acidez. Observa-se ainda que, em cada reator, o desempenho do catalisador H3PO4/SiO2 foi superior ao observado para a alumina, tanto em grau de transformação (%PL), como em teor de ácidos livres.
A transformação do óleo de soja hidrogenado, índice de iodo igual a 10, realizada sobre o catalisador de Al2O3-g, em reator contato vapor, apresentou um produto líquido com distribuição semelhante a do óleo diesel. No entanto, a introdução da etapa de hidrogenação ao processo de craqueamento, o torna mais oneroso.
Paralelamente aos estudos em andamento, procurou-se realizar a hidrogenação e o craqueamento do óleo em uma única etapa. Para tal, foram realizados testes com 2,0 g de catalisadores de molibdênio, em reator de leito fixo e fluxo contínuo, a 400 oC, sob fluxo de hidrogênio, de 0.33 cm3.s-1. Os resultados destes testes estão resumidos na tabela 4.
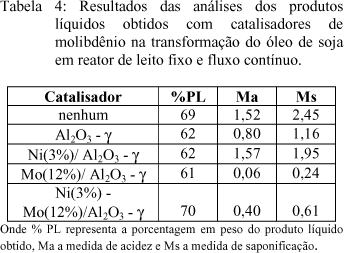
Comparando-se os resultados da tabela 4, verifica-se que todos os catalisadores apresentaram a capacidade de retirar oxigênio do óleo de soja com um rendimento razoável em produto líquido. Pode-se ainda notar que mesmo o craqueamento térmico causa modificações no óleo original (Ma=0,01 e Ms=3,34).
Teoricamente, o rendimento máximo em produto líquido, no craqueamento é de aproximadamente 85% quando todos os átomos de oxigênio tiverem sido retirados na forma de CO2 gasoso. Quando a estrutura do triglicerídeo se quebrar, o rendimento será aproximadamente 80%, no caso do óleo de soja. Portanto, o rendimento de 70% conseguido neste testes significa um valor relativamente alto.
A tabela 5 apresenta os resultados obtidos nas análises químicas dos produtos das reações de craqueamento térmico e de reforma do óleo de soja.
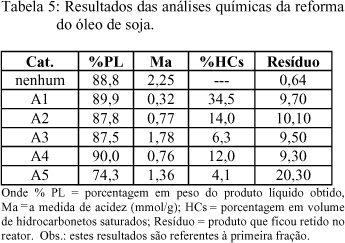
O aumento da acidez (Ma=2,25) do produto líquido proveniente do craqueamento térmico (CT) quando comparado com do óleo de soja (Ma=0,06), indica que a maior parte do óleo se converte em ácido graxo. No entanto, com a reforma catalítica a acidez do produto líquido diminui, provavelmente devido a uma parte dos ácido graxo, que sofre descarboxilação ou descarbonilação formando hidrocarbonetos saturados. Observa-se que o teste catalítico (CCi) realizado com o Nb2O5 calcinado a 150 oC (A1), mostrou melhor rendimento com 34,5% de hidrocarbonetos saturados provavelmente devido a sua alta acidez total e a presença de sítios de Brönsted, que favorecem a reação de craqueamento.
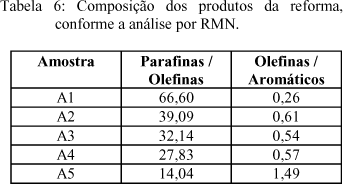
A análise do espectro de RMN 13C do produto líquido do craqueamento térmico (CT) possui alto teor de ácido graxo, mostrado pelo deslocamento químico assinalado em 180 ppm, o que está de acordo com a sua alta acidez de 2,25, confirmando que o ácido é o intermediário da reação e pode ser utilizado como composto modelo. A análise do espectro de RMN de prótons do produto líquido CC1, mostrou na faixa de 0,7 a 1,8 ppm um multiplete característico de prótons oriundos de CH3, CH2 e CH ao longo de cadeias alifáticas. A partir da integração dos picos dos espectros obtidos por esta técnica determinou-se as relações mostradas na tabela 6.
Os compostos constituintes dos produtos líquidos foram identificados por espectrometria de massas de acordo com a sua seqüência de fragmentação. Os picos do íon molecular (M) da cadeia de hidrocarboneto linear saturado, foram caracterizados pela perda de 14 unidades de massa correspondentes ao CH2. A presença de compostos aromáticos foram identificados por um pico base (intenso) em m/e igual a 91 (C6H5CH2+) característico do rearranjo do anel aromático, íon tropílio, acompanhado de um pico de m/e igual a 65 (C5H5+), que resultou da eliminação de uma molécula neutra de acetileno.
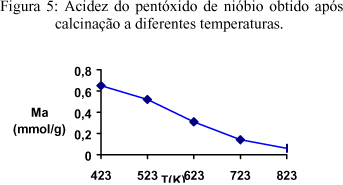
Os resultados de medida de acidez total (indicador: p-dimetilaminoazobenzeno) são mostrados na figura 5. Observa-se que, quanto maior a temperatura de calcinação menor a acidez total do Nb2O5-TT.
Os sítios ácidos presentes na superfície deste óxido foram identificados, por adsorção de piridina acompanhada por espectroscopia de infravermelho. A análise dos espectros mostra que as bandas com número de onda de 1538 e 1445cm-1 correspondem aos sítios ácidos de Brönsted e Lewis, respectivamente.
Duas séries de fragmentação foram observadas no espectro, características dos ácidos de cadeia longa. Estas resultaram da quebra de cada ligação C-C, com retenção de carga pelo fragmento contendo O (m/e 45,59, 73,87...) e pelo fragmento alquila (m/e 29, 43, 57, 71, 85).
A análise do espectro de infravermelho do produto líquido obtido do craqueamento térmico, CT, indicou a presença de ácidos carboxílicos, compostos aromáticos e cetonas. Comparando este espectro com aquele obtido com o craqueamento catalítico, CC1, observou-se uma redução das bandas características de ácidos e cetonas, principalmente o correspondente a vibração C=O em 1710 cm-1 e aumento das bandas características de daCH em 3047, na CH3 em 854 e 2925 cm-1 e desaparecimento das bandas de C-O em 1283 e 1240 cm-1. Estes resultados confirmam aqueles encontrados pela medida de acidez e de hidrocarbonetos saturados e evidenciam o efeito catalítico do pentóxido de nióbio nesta reação
A comparação dos espectros dos produtos líquidos CC2, CC3 e CC4 mostrou que a medida em que a acidez do catalisador decresce, há uma diminuição da conversão de ácidos, mostrada pelo aumento da vibração de C=O em 1711 cm-1 e surgimento de bandas de C-O em 1285 cm-1 e de ácidos carboxílicos dímeros em 966 cm-1
CONCLUSÕES
Uma avaliação global destes trabalhos pode-se concluir que:
-A primeira etapa do processo é essencialmente térmica, não havendo influência do catalisador.
-A degradação primária dos triglicerídeos, que forma o óleo vegetal, gera predominantemente ácidos carboxílicos, a partir dos quais são formados os hidrocarbonetos, resultando sempre numa mistura onde estes dois tipos de composto aparecem em maior proporção.
-O catalisador que apresentou os melhores resultados foi o de H3 PO4 /SiO2 .
-Os produtos de reação de reforma do óleo de soja são de natureza semelhante àqueles encontrado no petróleo, conforme a análise feita por cromatografia gasosa(4)
-Os catalisadores de Nb2O5 mostraram-se promissores para a reação de reforma de óleos
-A acidez pode estar presente no petróleo cru ou ser gerada durante o processo de refino. Esta normalmente é decorrente de compostos hidrogenados de enxôfre, de ácidos naftênicos ou de outros ácidos orgânicos. Os produtos do craqueamento do óleo de soja em catalisadores de Nb2O5 também são ácidos, porém apresentam a vantagem de não possuírem enxôfre sendo portanto, menos poluentes.
-O aumento da temperatura de calcinação causou decréscimo da acidez total do Nb2O5 em decorrência da desidroxilação de sua superfície.
-O catalisador A1, foi mais efetivo para a reação de reforma, conforme verificado pela presença de hidrocarbonetos saturados e pela redução da acidez do produto líquido.
REFERÊNCIAS
1) Brandes, R - Arch.D Pharm, 2,15, 120 (1838).
2) Engler e Seidner, Dinglers Polytech . J., 269, 136 (1888).
3) Mailhe, A., Bull.Soc.Chim.Fr., 31,249 (1922).
4) Kobayashi, K., J.Soc.Chem.Ind.Japan, 24 , 1421 (1921).
5) Waterman e Perquin, Proc.Acad.Sci.Amsterdam, 27, 83 (1924).
6) Faragler, W.F., Englof,G. e Morrell, J.C., l Ind.Eng.Chem., 24 , 440 (1932).
7) Egloff,G. e Morrell,J.C., Ind.Eng.Chem., 24, 1426 (1932).
8) Egloff,G. e Nelson,E.F., Ind.Eng.Chem., 25 386 (1933).
9) Chang, Ke-Chung e Chang,H.Y., J.Chinese Chem.Soc., 2, 221(1934).
10) Ping, K., J.Chinese Chem.Soc., 3, 95 (1935).
11) Ping,K., J.Chinese Chem.soc., 3, 281(1935).
12) Tsung - Shih lo e liu Sheng Ts'Ai , J. Chinese Chem.Soc., 3 , 157 (1936) .
13) Chang , C.H. , Shiashi ,C.D. e Chang, C.W., J. Chinese Chem.Soc., p 100 0ct (1941).
14) chia-Chu Chang e Shen - Wu Wan, Ind. Eng. Chen., 39, 1543 (1947).
15) Sun, Y.C., J.Chinese Chen.Soc ., p 108 oct (1941).
16) Suen, T.J. e Wang, K.C.,J.Chinese Chen.Soc., p93 oct (1941).
17) Dalal, N.M. e Mehta, T.N., J.Ind. Chen..Soc ., 2, 213 (1939).
18) Mandeklar; M.R ., Mehta , T,N., Parekh, V.M. e Thosar, V.B, J.Ind.Chen .Soc., 9, 110, 1 (1947)
19) Mandeklar; M..R., Mehta, T.N., Parekh, V.M. e Thosar, V.B., J.Ind.Chen.Soc., 10, 1 (1947)
20) Daruwala, E..D, Mandeklar, M.R, Mehta, T.N. e Parekh, V.M., Ind.Chen.Soc., 10, 107 (1947).
21) Silva, J.G., Ribeiro, F.H., da Silva, A., Frety, R., Lam, Y.L., 7o Simpósio Ibero- Americano de catálise - La Plata, Argentina, 169 (1980).
22) Ribeiro, F.H.L.A, Valença, G.P., da Silva, J.G., da Silva, M.E.F., Fonres Alternativas de Energia - óleos vegetais - Hidrogenação. Projeto de fim de Curso de Engenharia Química -Instituto Militar de Engenharia (1982)
23) Dos Anjos., J.R.S., Tese de Mestrado - Instituto Militar de Engenharia Rio de Janeiro (1981).
24) Pastura, N.M.R., Tese de Mestrado - Instituto Militar de Engenharia Rio de Janeiro.(1982)
25) Fernandes, M..A.G., Tese de Mestrado , Instituto Militar de Engenharia, Rio de Janeiro.
26) Dos Anjos, J.R.S., Lam,Y.L.e Frety, R., Boletin Técnico Petrobrás, 24, 139 (1981)
27) Dos Anjos, R.R.S., Gonzalez, W..A , Lam Y.L. e Frety, R ., Applied. Catalisys, 5, 299 (1983)
28) Fernandes, M.A.G., Pastura, N.M.R. e Lam, Y.L., Anais do 3o Seminário de catálise, Salvador, 135 (1985).
29) Lam,Y.L. e Fernandes, M..A.G., Anais IV Jornadas Argentinas de catálise, Bahia Blanca (1985).
30) Pastura, N.M.R., Fernandes,M.A.G., Timm, P . e Nunes,P.P., Trabalhos Técnicos do 4o Seminário Brasileiro de catálise , 508 (1987).
31) Gonzalez, W.A., Pastura, N..M.R., Martins, E.P. e Nunes, P.P., Trabalhos Técnicos do 4o Seminário Brasileiro de catálise, 532 (1987)
32) International Union of Pure and Applied Chemistry - Applied Chemistry Division - Comission on Oils, Fats and Derivativeis - Standard Methods for the Analysis of Oils, Fats and Derivativeis - 6° ed. part I (Section I and II) (1972).
33) Benedito,S.E., Valverde, L.F.M., Sousa , F. M., Pastura, N.M.R., Gonzalez, W.A. , PFC/ IME,1997.
34) Benedito,S.E., Valverde, L.F.M., Sousa , R.B., Reguera, F. M., Pastura, N.M.R., Gonzalez, W.A., 10 Congresso Brasileiro de Catálise, Salvador,1999.










 Como citar este trabalho
Como citar este trabalho