An. 6. Enc. Energ. Meio Rural 2006
Sistemas catalíticos na produção de biodiesel por meio de óleo residual
Carlos Alexandre de Souza
UNIFEI - 5º Ano de engenharia hídrica
RESUMO
Os óleos vegetais aparecem como uma alternativa para a substituição ao óleo diesel em motores de ignição por compressão, no entanto, devido sua alta viscosidade o processo torna-se inviável. Ao submeter o óleo à uma reação de transesterificação, obtém-se um combustível com as mesmas características do diesel, chamado Biodiesel. De caráter simples, esta reação é favorecida mais ou menos de acordo com os catalisadores e sua natureza, podendo ser ácidos, básicos ou biológicos. De maneira geral, 85% do custo do Biodiesel é proveniente da fase de produção do óleo. Por meio da transesterificação o óleo vegetal pode se transformar em uma mistura de ésteres de ácidos graxos, tendo como resíduo a glicerina. O óleo residual tem se apresentado como uma possibilidade entre as matérias-primas do Biodiesel, devido sua fácil aquisição e a viabilidade em não descartá-lo como resíduo.
Palavras-chave: Biodiesel, Óleo residual de fritura, Óleo reciclado.
ABSTRACT
The vegetable oils and fat animals appear like an alternative for substitution the diesel oil in ignition engines for compression. Submiting the oil on transesterification reaction, you have an fuel with same caracters of diesel, it's called Biodiesel. Being an simple reaction, it is helped with presence of catalysts and its nature: acid, basic or biological. Generally, 85 per cent of biodiesel's cost is from the oil's production. With transesterification the oil can be transformed in a ester mixture of grax acids. The residual oil has showed like a possibility between the raw materials of Biodiesel, because its easy acquisition and the viability in don't through away as residual.
I - Revisão Bibliográfica
Introdução
Atualmente, a reciclagem de resíduos agrícolas e agro-industriais vem ganhando espaço cada vez maior, não simplesmente porque os resíduos representam "matérias primas" de baixo custo, mas, principalmente, porque os efeitos da degradação ambiental decorrente de atividades industriais e urbanas estão atingindo níveis cada vez mais alarmantes. Vários projetos de reciclagem têm sido bem sucedidos no Brasil e dentre eles destacam-se o aproveitamento de papel, plásticos, metais, óleos lubrificantes automotivos e industriais, soro de leite e bagaço de cana. Mais recentemente, a implantação de Programas de Qualidade Total tem reduzido o impacto poluidor de várias atividades de natureza agroindustrial. No entanto, muitos casos ainda prevalecem sem qualquer proposta de solução definitiva. Dentre os materiais que representam riscos de poluição ambiental e, por isso, merecem atenção especial, figuram os óleos vegetais usados em processos de fritura por imersão. Segundo o Centro de Saúde Ambiental da Prefeitura Municipal de Curitiba, estima-se que somente nos restaurantes industriais da cidade e região metropolitana, são mensalmente geradas cerca de 100 toneladas de óleos de fritura, cujos destinos incluem a produção de sabão, de massa de vidraceiro e de ração animal, mas que também têm parte de seu volume descartado diretamente no esgoto doméstico.
Produção de Biodiesel
Existem três processos básicos para a produção de biodiesel: formação de microemulsões, pirólise e transesterificação. Entretanto, a transesterificação de triglicerídeos é o processo utilizado em larga escala. A figura 1 apresenta uma reação de transesterificação típica para a produção de biodiesel.
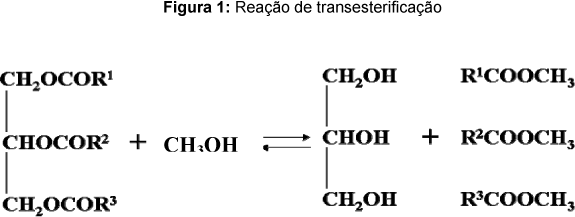
Do ponto de vista cinético, a transesterificação pode ser conduzida em processos catalisados por ácidos, enzimas ou bases fortes. A catálise básica é, indiscutivelmente, a mais utilizada em todo mundo. A produção industrial de biodiesel é, em sua quase totalidade, conduzida por esta rota. Os processos que pretendem ser abordados no presente trabalho se referem à catálise ácida e à catálise básica.
Catálise Básica
Os catalisadores utilizados na catálise básica são bases fortes como KOH (hidróxido de potássio), NaOH (hidróxido de sódio), carbonatos e metóxidos, etóxidos e, em menor grau, propóxidos e butóxidos de sódio e potássio.
Nestes processos, a base é dissolvida no álcool utilizado, e adicionada ao óleo. São utilizados reatores agitados, com ou sem aquecimento. O tempo de reação típico é de cerca de 1-2 horas. Após a transesterificação, o produto obtido é uma mistura de ésteres, glicerol, álcool, tri, di e monoglicerídeos.
Em suma, as principais etapas envolvidas são: mistura, reação de transesterificação, decantação do glicerol, recuperação do álcool em excesso, e separação do glicerol.
A utilização de catalisadores básicos permite obter taxas de reação quase 4000 superiores as obtidos pela mesma quantidade de catalisadores no processo ácido. Além disso, o custo das bases fortes é bastante inferior ao das enzimas utilizadas como biocatalisadores, além de vantagens adicionais associadas à disponibilidade dos catalisadores básicos que, apesar das dificuldades de recuperação, permitem a reutilização como catalisadores sem perda de atividade. A catálise básica permite a utilização de temperaturas e pressões menores, diminuindo os custos energéticos e de instalação dos reatores. Além disso, a catálise alcalina permite o uso de menores relações molares álcool / óleo.
Entretanto, devido à possibilidade de saponificação, o processo é limitado a óleos de baixa acidez, de maior preço, dificultando a utilização de resíduos ou óleos não processados, mais baratos. No caso de se utilizar resíduos de óleos não processados é necessária a utilização de metanol ou etanol anidro, que são mais caros que seus correspondentes hidratados. A separação, recuperação e purificação do glicerol e dos catalisadores é dispendiosa e demorada. O tempo de reação necessário é relativamente longo, e como o processo transcorre em reatores agitados, o consumo energético é alto e os custos associados também são. Assim, embora a melhor alternativa no presente, o processo alcalino está longe de ser completamente otimizado para produção de éster etílico de óleo vegetal.
Catálise Ácida
Os ácidos utilizados no processo de transesterificação incluem ácido sulfúrico, sulfônico, fosfórico ou hidroclórico, entre outros. Destes, o ácido sulfúrico é o mais utilizado.
Entre as possibilidades associadas à catálise ácida está a transesterificação in-situ onde a matéria-prima rica em triglicerídeos é adicionada diretamente à solução alcoólica acidificada, ao invés de se reagir o óleo purificado com o álcool. Desta forma, a extração do óleo e a transesterificação ocorrem juntas.
A catálise ácida apresenta taxas de conversão de triglicerídeo muito inferiores aos obtidos na catálise básica homogênea e demanda quantidades maiores de catalisador e relações álcool / óleo mais altas. Os tempos de reação são mais longos e o consumo energético maior, visto que a maioria dos processos demanda aquecimento.
Contudo, a rota ácida permite a utilização de óleos e gorduras que possuem um alto teor de ácidos graxos livres, como muitos óleos vegetais não refinados e resíduos industriais e domésticos ricos em triglicerídeos, como óleos de fritura usados. Portanto a rota catalítica ácida poderá vir a desempenhar um papel relevante no futuro, no que diz respeito à produção de biodiesel.
De acordo com a bibliografia consultada, óleos apresentando conteúdo de ácidos graxos inferior a 1% são ideais para a produção de biodiesel, com conversão total do triglicerídeo ao éster. Dependendo do ajuste dos outros parâmetros reacionais (razão molar álcool/óleo, quantidade de catalisador, uso ou não de temperatura reacional1) poderão ser utilizados óleos com acidez entre 1 e 3%.
Uma das mais importantes variáveis afetando a conversão do éster é a razão molar do álcool em relação ao triglicerídeo. A razão estequiométrica da transesterificação requer três moles de álcool por mol de triglicerídeo2, obtendo três moles do éster e um mol de glicerol3. Altas razões molares favorecem conversão total do óleo a éster em um curto período de tempo (Ma & Hanna, 1999).
A razão molar está fortemente associada com o tipo de catalisador utilizado. Uma reação de catálise ácida necessita de um razão de 30:1 de butanol para óleo de soja, enquanto que a catálise alcalina requer somente uma razão de 6:1 para obter a mesma conversão em um mesmo período de tempo (Freedman et Al.,1986).
Freedman e colaboradores estudaram o efeito da razão molar (variando de 1:1 até 6:1) na conversão do éster com óleos vegetais. Óleos de soja, girassol e óleo de algodão apresentaram comportamentos similares e obtiveram altas conversões (93-98%) com uma razão molar de 6:1. Este resultado é confirmado por Tomasevic & Marinkovic (2002) para a transesterificação por metanol de óleo de fritura usado Nye et Al. (1983) para a produção de biodiesel metílico a partir de óleo de colza, usando NaOH e KOH na proporção 1% (peso) em relação à quantidade inicial de óleo.
Já Antolín et Al. (2001) apresentam 9:1 como razão molar álcool / óleo ótima para a transesterificação metílica de óleo de girassol. Foram utilizadas temperaturas reacionais de 60°C e 70°C.
Existem poucos dados sobre a razão molar ótima para a transesterificação etílica de triglicerídeos. Para a produção de biodiesel a partir de óleo de amendoim, uma proporção molar inicial etanol / óleo de 6:1 foi considerada a mais adequada (Feuge & Grose, 1949).
Em relação à influência do tempo de reação, Freedman e colaboradores transesterificaram óleos de sementes de algodão, girassol e óleo de soja sobre condições de metanólise de 6:1; 0,5% de metóxido de sódio como catalisador e a 60°C. Uma conversão de aproximadamente 80% foi observada após um minuto de reação com óleo de soja e óleo de girassol. Após uma hora, a conversão foi aproximadamente a mesma para ambos os óleos.
Existem estudos para a reação de transesterificação para diferentes temperaturas. Na metanólise do óleo de mamona em metil ricinoleato a reação procede muito rapidamente na faixa de 20-35°C com NaOH como catalisador (Smith, 1949). Para transesterificação do óleo de soja com metanol utilizando 1% NaOH como catalisador e relação molar metanol / óleo 6:1, três diferentes temperaturas foram utilizadas. Após seis minutos as conversões foram de 94, 87 e 64 para 60, 45 e 32°C, respectivamente (Freedman et Al., 1984).
Transesterificação
Os óleos vegetais mais comuns são obtidos por extração química ou mecânica, a partir de sementes oleaginosas: girassol, couve silvestre, soja ou frutos como a palmeira e o amendoim.
Os ésteres metílicos ou etílicos dos óleos vegetais são obtidos por reação dos óleos vegetais com metanol (tóxico e originário de fontes fósseis) ou etanol (álcool de cana, mais ecológico e propício para seu uso no Brasil) através do processo denominado transesterificação, que em presença de um catalisador, via de regra hidróxido de sódio (NaOH) ou hidróxido de potássio (KOH), transforma os óleos vegetais em biodiesel (ésteres) e glicerina (LADETEL/USP, 2003).
Após a reação, o produto é decantado e a glicerina , por diferença de densidade, precipita-se, sendo então retirada e restando o biodiesel..
Processo

Na transesterificação, o óleo vegetal reage com um álcool (metanol ou etanol) na presença de um catalisador, formando um éster (éster monoalquilado de ácidos graxos de cadeia longa) denominado biodiesel.
Biodiesel de óleo usado em frituras
Nye et al.21 investigaram a reação de transesterificação de óleos de fritura com metanol, etanol, n-propanol, iso-propanol, n-butanol e 2-etoxietanol em meios ácido e básico. O maior rendimento foi obtido com o metanol em meio alcalino, utilizando hidróxido de potássio como catalisador. Nesse mesmo estudo, alguns dos ésteres de menor viscosidade foram selecionados para a realização de testes preliminares em motores do ciclo diesel. O éster metílico obtido em meio básico, e os ésteres etílico e butílico obtidos em meio ácido, não apresentaram problemas de ignição e desempenho, apresentando pouca ou nenhuma fumaça na exaustão. Os demais ésteres não foram testados por critérios de viscosidade e o rendimento da reação não serviu como parâmetro para a seleção dos ésteres a serem utilizados nos testes. Segundo Mittelbach e Tritthart22, a utilização de biodiesel de óleos de fritura em motores do ciclo diesel apresentou bons resultados. Os testes foram realizados em bancada dinanométrica e em veículo de carga média com motor turbinado a diesel. Por outro lado, a avaliação da emissão de gases demonstrou que houve um aumento relativo na liberação de gases nitrogenados, particularmente quando o biocombustível foi comparado ao diesel convencional. A tabela 1 apresenta algumas das características físicas e químicas do biodiesel usado nesses testes.
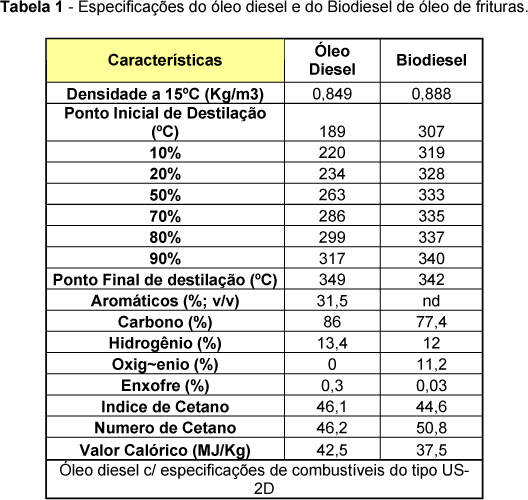
Apesar de não atender a uma especificação definida, o biodiesel de óleos de fritura apresentou características bastante semelhantes aos ésteres de óleos "novos". Além dos excelentes resultados obtidos por esses e outros autores, é inevitável admitir que o óleo de fritura traz consigo muitas impurezas, oriundas do próprio processo de cocção de alimentos. Portanto, para minimizar esse problema, é sempre aconselhável proceder uma pré-purificação e secagem dos óleos antes da reação de transesterificação..
II Parte Experimental
Pesquisa de Campo
Uma pesquisa de campo foi feita pelo pesquisador nos estabelecimentos comerciais de Itajubá-MG, a fim de se obter dados a respeito de como esse óleo residual é tratado posteriormente após o uso e também se existe a possibilidade de matéria prima para a realização dos experimentos. Segue em anexo uma tabela da pesquisa realizada.
Parte Laboratorial
Objetivo
Testar alguns catalisadores, para que possamos analisar qual deles terá melhor rendimento, em uma quantidade mínima, pois os catalisadores são uns dos insumos de maior preço dentro do processo de transesterificação. Desta forma foram feitas várias combinações dos reagentes para a produção do Biodiesel.
Material Utilizado
- Béquer 600 mL, 250 mL, 100 mL, 50 mL;
- Funil de separação 1000 mL, 500 mL, 250 mL;
- Pipeta de 25 mL;
- 1 Pêra;
- Vidro de relógio;
- Funil de vidro;
- Espátula;
- Potes de vidro de "Gatorade" 500 mL, para armazenamento do Biodiesel e glicerina;
- Termômetro (Escala de 0º a 100º C);
- 1 Agitador Mecânico;
- Chapa aquecedora Tecnal TE-038;
- Balança MARTE / Modelo AS5500 C;
- Suporte Universal;
- Bastão de Vidro;
- Equipamentos de segurança: óculos, Luvas e máscara;
Reagentes Utilizados
- Methanol Baker Analyzed A.C.S. Reagent;
- Catalisador Degussa NE 21 Natriumethylatlosung 21% in Ethanol;
- Catalisador Degussa NM 30 Natriummethylatlosung 30% in Methanol;
- Catalisador BASF K- Methylat Krist;
- Catalisador BASF Na- Methylat Krist;
- Catalisador BASF Na- Ethylat Krist;
- Sulfato de Sódio anidro;
- Óleo residual de fritura;
Procedimento Experimental
No processo de obtenção do Biodiesel a partir de óleo residual de fritura, temos que primeiramente que preparar os reagentes e materiais que serão utilizados na reação de transesterificação. Coloca-se em um béquer 100g de óleo residual de fritura, e 50g de Metanol em um béquer menor utilizando a pipeta. Logo após pesa-se em um vidro de relógio a quantidade de catalisador necessária para a reação, que será variável nas condições do experimento. Em seguida dilui-se o catalisador básico no Metanol, através de um bastão de vidro, agitando-o manualmente até que se dilua totalmente o catalisador. Esquenta-se o óleo residual dentro do béquer na chapa aquecedora a uma temperatura de 45º C, temperatura esta controlada pelo termômetro que é colocado junto ao óleo residual. Nesse processo temos um agitador mecânico que em todo instante fica agitando o óleo até o final do processo da reação. Logo após atingir a temperatura de 45º C, adiciona-se ao óleo residual o Metanol mais o catalisador já diluído no mesmo. O tempo de reação foi de aproximadamente 5 minutos, pois neste tempo foi constatada a conversão completa de ésteres pelo escurecimento brusco da mistura, seguida de retorno da coloração inicial da mistura. Após esse tempo retira-se da chapa a mistura e agita-se manualmente com o bastão de vidro por aproximadamente mais 5 minutos. Coloca-se então a mistura para decantar por um período prolongado para que haja a separação da glicerina com o biodiesel produzido (aproximadamente 24 horas). Após esse período de decantação feito no funil de separação, tiramos a glicerina e biodiesel onde foram colocados nos potes de vidro. Após esse processo, lava-se o Biodiesel da seguinte forma: Esquenta-se na chapa aquecedora o volume de água correspondente ao de Biodiesel produzido no processo anterior, até essa água atingir a temperatura de aproximadamente 90º C. Coloca-se 2 gotas de ácido clorídrico na água. Logo em seguida coloca-se o Biodiesel mais a água a 90º C no funil de separação. Agita-se lentamente por volta de 5 minutos o funil de separação. Após esse processo coloca-se o funil de separação para decantação por um período prolongado. Feito isso, retira-se à água com o excesso de álcool do funil de separação. Nesse excesso coloca-se 2 gotas de fenoftaleína para conferir a acidez do Biodiesel. Se com a adição de 2 gotas de fenoftaleína a solução ficar rosa, tem-se de lavar novamente o Biodiesel até que a solução fique neutra. E finalmente filtra-se o Biodiesel restante no funil de separação, através de um filtro de papel onde se tem sulfato de sódio anidro. Feito isso, pesa-se o Biodiesel produzido.
Os resultados obtidos nos 15 experimentos serão apresentados a seguir.
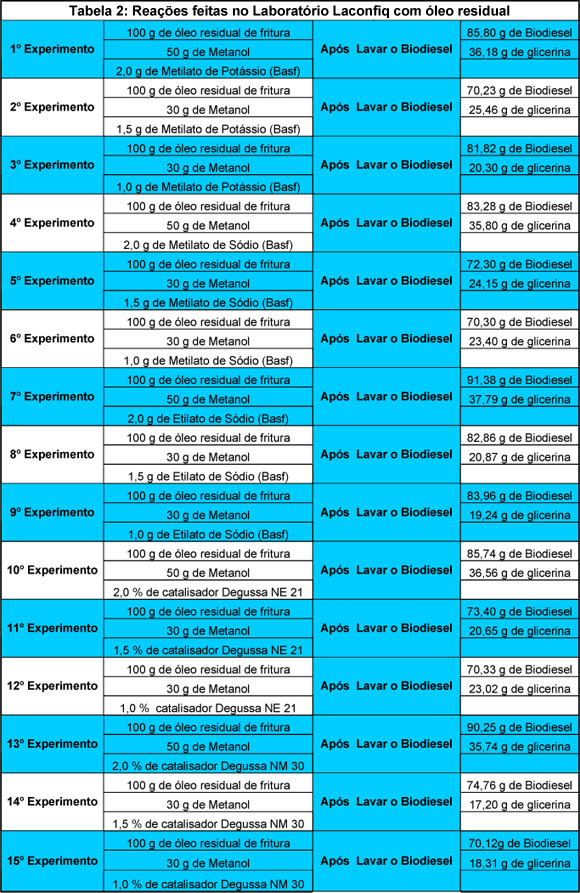
Análise dos Resultados
Conclui-se que das várias combinações de reagentes utilizados nos experimentos, temos que:
- Para 50% de Metanol e com utilização de 2% de catalisador básico o Etilato de Sódio da BASF, utilizado no 7º experimento teve maior rendimento em relação aos outros catalisadores.
- Para 30 % de Metanol e com utilização de 1,5 de catalisador básico, o Etilato de Sódio da BASF, utilizado no 8º experimento teve maior rendimento em relação aos outros catalisadores.
- Para 30% de Metanol e 1% de catalisador básico, o Etilato de Sódio da BASF, utilizado no 9º experimento teve maior rendimento em relação aos outros catalisadores.
Obs: Para todos os experimentos foram mantidas as proporções de 100% de óleo residual de fritura, ou seja, 100g de óleo residual. Variou-se apenas a quantidade de álcool utilizado de 50% para 2% de catalisador, e de 30% de álcool para 1,5% e 1% de catalisador. Fica explícito que o catalisador BASF de Etilato de Sódio obteve maior rendimento nesses experimentos.
III Conclusão
A utilização de biodiesel como combustível tem apresentado um potencial promissor no mundo inteiro. Em primeiro lugar, pela sua enorme contribuição ao meio ambiente, com a redução qualitativa e quantitativa dos níveis de poluição ambiental, e, em segundo lugar, como fonte estratégica de energia renovável em substituição ao óleo diesel e outros derivados do petróleo. Vários países vêm investindo pesado na produção e viabilização comercial do biodiesel, através de unidades de produção com diferentes capacidades, distribuídas particularmente na Europa (França, Áustria, Alemanha, Bélgica, Reino Unido, Itália, Holanda, Finlândia e Suécia), na América do Norte (Estados Unidos) e na Ásia (Japão). Com essa pesquisa fica identificado um destino mais adequado a este óleo residual desprezado e/ou parcialmente aproveitado de maneira muitas vezes inadequada. Finalmente, é importante ressaltar que um programa de substituição parcial de óleo diesel por biodiesel de óleo de fritura dependeria da criação de um eficiente sistema de coleta de óleos usados, o que certamente encontra-se distante de nossa realidade.
IV Bibliografia
ABIOVE - Associação Brasileira das Industrias de Óleos Vegetais - site: www.abiove.com.br
ALI, Y.; HANNA, M.A.; CUPPETT, S.L.: Fuel Properties of Tallow and Soybean Oil Esters. JAOCS 72(12): 1557-1564, 1995.
ALMEIDA NETO, J. A., SAMPAIO, L. A. G., NASCIMENTO, C. S. Projeto BioCombustível: processamento de óleos e gorduras vegetais in natura e residuais em combustíveis tipo diesel. IN:
AMARAL, Luciano do: - Química Orgânica/- Editora Moderna - 2 edição revisada e atualizada - 1985
BAGBY, M.O.; FREEDMAN, B.: Diesel Engine Fuels from Vegetable Oils. Paper presented at 86th Annual Meeting, American Oil Chemists' Society, 1989.
COELHO, Suani Teixeira: - Análise dos Aspectos Técnicos, Ambientais e Socioeconômicos Programa Interunidades De Pós-Graduação Em Energia - Contextualização do Biodiesel — Dezembro 2002
CULSHAW, F.; BUTLER, C.: A Review of the Potential of Biodiesel as a Transport Fuel (Reports). New York, The Stationery Office Books; 1993.
DORSA, R.; "Tecnologia de Processamento de Óleos e Gorduras Vegetais e Derivados" - 3ª Edição - 2000.
EPA - Life-Cycle Assessment: Inventory Guidelines and Principles - february 1993.
FREEDMAN, B.; BAGBY, M.O.; Heats of Combustion of Fatty Esters and Triglycerides. JAOCS 66(11): 1600-1605, 1989.
FREEDMAN, B.; BAGBY, M.O.; Predicting Cetane Numbers of n-Alcohols and Methyl Esters from their Physical Properties. JAOCS 67 (9): 565-571, 1990.
FALKMANN, E. G.: Sustainable Production and Consuption. WBCSD publications, 1996.
JANARTHANAN, A.K.; CLEMENT, E.D.; CLEMENTS, L.D.: Densities and Viscosities of Methyl Esters of Fatty Acids and Their Mixtures. Submitted to JAOCS, 1996.
KLOPFENSTEIN, W.E. : Effect of Molecular Weights of Fatty Acid Esters on Cetane Numbers as Diesel Fuels. JAOCS 62(6): 1029-1031, 1985.
LADOMMATOS, A.K.; GOACHER, J.: Equations for predicting the Cetane Number of Diesel Fuels from their Physical Properties. Fuel 74(7): 1083-1092, 1995.
LEE, I.; JOHNSON, L.A.; HAMMOND, E.G.: Use of Branched-Chain Esters to Reduce the Crystallization Temperature of Biodiesel. JAOCS 72(10): I 155- I 160, 1995.
SHREVE, R. N.; BRINK, J. A. Jr.; "Indústrias de Processos Químicos" - Tradução de Horacio Macedo, Editora Guanabara, quarta edição.
TICKELL, J. ; ROMAN, K. (Editor); TICKELL, K. ; "From the Fryer to the Fuel Tank: The Complete Guide to Usin Vegetable Oil as na alternative Fuel". New York, Veggie Van Publications, 2000.
1 Temperatura ideal para a ocorrência da reação.
2 Ou seja, a relação mássica para o óleo de soja seria 2,05 vezes superior a massa de álcool etílico utilizada (como o peso molecular do álcool etílico ≅ 46g/mol, do óleo de soja ≅ 282,4g/mol e a relação molar 3:1 respectivamente, temos que são necessários aproximadamente 138g de álcool por 282,4g de óleo de soja se tomarmos como base de cálculo a relação molar proposta).
3 Isso significa que para 1 mol de glicerol (≅ 92g/mol) teríamos o equivalente aproximado em massa de 92g de glicerol e para 3 mols de biodiesel (≅ 109,5g/mol - CENBIO) teríamos o equivalente aproximado em massa de 328,4g de biodiesel (se tomarmos como base de cálculo a relação molar proposta), para uma reação com 100% de rendimento.
V - Anexo
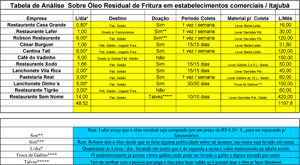
Tabela de Análise - Clique aqui para ampliar










 How to cite this paper
How to cite this paper